ACESSO RESTRITO
ACESSO RESTRITO
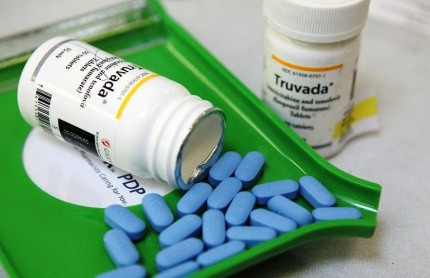
O Brasil pode ter o primeiro genérico do Truvada, remédio que previne a infecção pelo vírus HIV e atualmente é importado para o Brasil a um custo elevado. Segundo a Agência Brasil, a Blanver, empresa brasileira integrante do grupo de indústrias farmacêuticas que firmaram Parcerias para o Desenvolvimento Produtivo (PDPs) com o Ministério da Saúde (MS), desenvolveu o genérico e entrará com o pedido de registro na Agência Nacional de Vigilância Sanitária (Anvisa), nos próximos dias, informou nesta terça-feira (5) o presidente-executivo (CEO) da empresa, Sérgio Frangioni. No momento, o dossiê sobre o genérico está em fase de finalização.
Segundo as PDPs, a indústria desenvolve a tecnologia de medicamentos e tem o prazo de cinco anos para transferir essa tecnologia para a Fundação Instituto Oswaldo Cruz (Fiocruz). No fim desses cinco anos, a Fiocruz domina o processo e passa a fornecer o medicamento diretamente para o Ministério.
O Truvada é composto por dois princípios ativos (entricitabina e tenofovir). Quando tomado diariamente, ele reduz o risco da pessoa contrair o vírus HIV. Frangioni afirmou que já foram cumpridas todas as etapas do processo de desenvolvimento da droga, incluindo a formulação, iniciada em 2012, a estabilidade do produto e a fase de bioequivalência – quando o genérico é comparado com o produto de referência e tem sua eficácia comprovada.
Referência
Segundo Sérgio Frangioni o medicamento referência (Truvada) foi desenvolvido por um laboratório norte-americano e usado inicialmente para compor esquemas antirretrovirais para tratamento de pessoas já infectadas. A partir de 2012, a Food and Drug Administration (FDA), órgão do governo dos Estados Unidos para controle de medicamentos, entre outros produtos, liberou a fórmula para uso na prevenção da infecção.
A estratégia já é indicada pela Organização Mundial da Saúde (OMS) e passou a ser estudada pelo MS como uma alternativa a mais para diminuir o número de novos casos no Brasil.
Frangioni adiantou que o Truvada não tem disponibilidade no mercado nacional e, por isso, atualmente é importado. Ele esclareceu que a prevenção “é para o indivíduo que não foi exposto ao vírus”. Já para as pessoas que tiveram uma relação sexual de risco, o ministério fornece por meio do SUS a PEP (profilaxia pós-exposição), tratamento de 28 dias que deve ser inicado em até 72 horas após a relação.
Na Europa e Estados Unidos o Truvada custa 400 euros, podendo chegar a US$ 1 mil. A fabricação do genérico no Brasil, com o registro da Anvisa, pode reduzir esse valor para um custo mensal de US$ 100 ou cerca de R$ 350 mensais.
População vulnerável
Conforme o MS, o Brasil registra em média 40 mil novos casos da doença, por ano. As principais incidências estão entre homens que fazem sexo com homens e usuários de drogas injetáveis. “Esse grupo está muito mais exposto à atuação do vírus”, comentou Frangioni. Com o genérico do Truvada, a ideia da Blanver é focar nessas pessoas -- que compõem as populações mais vulneráveis --, para reduzir o número de novas infecções, além de profissionais do sexo.
“É melhor você prevenir, pontualmente, do que contrair o vírus e ter de tomar remédio pelo resto da vida. Isso se demonstrou bastante eficaz porque, infelizmente, hoje tem muita gente que não faz sexo seguro e imagina que o tratamento resolverá. A pessoa prefere o risco de pegar a doença, sabendo que tem um tratamento, mas não sabe as consequências em longo prazo. A ideia é dar essa ferramenta a mais para os desavisados se conscientizarem”, acrescentou Frangioni para a Agência Brasil.
Prevenção
Parte do medicamento genérico deverá ser distribuído pelo SUS e parte será destinado a pacientes fora do SUS. “Se você conseguir reduzir o número de casos novos, o governo contribuir para isso e a população tiver acesso ao medicamento, teremos uma ação positiva conjunta”, afirmou o executivo da indústria farmacêutica. Sua expectativa é que a Anvisa defina o registro do genérico em menos de um ano.
De acordo com a Agência Brasil, o medicamento não pretende substituir os métodos de prevenção já estabelecidos, mas se somar aos métodos existentes, como a camisinha masculina e feminina e os testes para Doenças Sexualmente Transmissíveis (DSTs).
Por meio da assessoria de imprensa, o Ministério da Saúde informou a Agência Brasil que ainda não há um pedido de incorporação do medicamento genérico do Truvada no órgão. A Anvisa disse que aguarda a entrada do pedido de autorização da indústria farmacêutica para avaliação.
-
 Genéricos ultrapassam 2,3 bilhões de unidades vendidas em 2025
09/02/2026
Categoria amplia presença em 24 das 27 unidades da Federação, com altas expressivas em Pernambuco, Sergipe, Rio de Janeiro e Rondônia.
Genéricos ultrapassam 2,3 bilhões de unidades vendidas em 2025
09/02/2026
Categoria amplia presença em 24 das 27 unidades da Federação, com altas expressivas em Pernambuco, Sergipe, Rio de Janeiro e Rondônia.
-
 Semaglutida pode turbinar lucro das farmácias em até 15%
16/01/2026
O fim da patente do Ozempic, medicamento à base de semaglutida da Novo Nordisk, deve ter efeitos que vão além da indústria farmacêutica. Segundo o Itaú BBA, o lucro das farmácias na bolsa de valores pode crescer até 15% com uma maior oferta de remédios com o princípio ativo. As informações são da CNN Brasil.
Semaglutida pode turbinar lucro das farmácias em até 15%
16/01/2026
O fim da patente do Ozempic, medicamento à base de semaglutida da Novo Nordisk, deve ter efeitos que vão além da indústria farmacêutica. Segundo o Itaú BBA, o lucro das farmácias na bolsa de valores pode crescer até 15% com uma maior oferta de remédios com o princípio ativo. As informações são da CNN Brasil.
-
 50+: sua farmácia está preparada para esse público?
10/11/2025
Segundo a Organização das Nações Unidas (ONU), a população com mais de 50 anos de idade saltou de 15,1% em 2000 para 27,9% em 2024. E a tendência deve se intensificar nas próximas décadas. Para 2050, esse grupo deve chegar a 42,3% dos brasileiros e, para 2078, estima-se que ele ultrapasse os 50%, impulsionando mudanças profundas na economia, na saúde e nos padrões de consumo.
50+: sua farmácia está preparada para esse público?
10/11/2025
Segundo a Organização das Nações Unidas (ONU), a população com mais de 50 anos de idade saltou de 15,1% em 2000 para 27,9% em 2024. E a tendência deve se intensificar nas próximas décadas. Para 2050, esse grupo deve chegar a 42,3% dos brasileiros e, para 2078, estima-se que ele ultrapasse os 50%, impulsionando mudanças profundas na economia, na saúde e nos padrões de consumo.