ACESSO RESTRITO
ACESSO RESTRITO
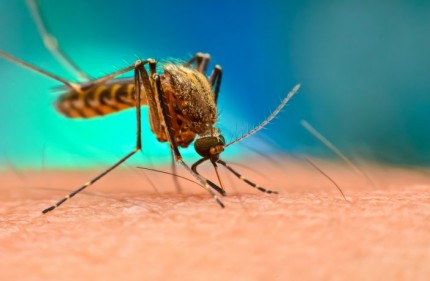
Após mais de 60 anos sem novidades no tratamento da doença, a tafenoquina é aprovada no Brasil para a cura radical (prevenção de recidiva) da malária recorrente por Plasmodium vivax. Em dose única, a tafenoquina possibilita a cura radical e pode facilitar a adesão ao tratamento. Isso representa um importante passo nos esforços de eliminação da malária.
Antes da tafenoquina ser disponibilizada para a população, será conduzido um estudo para explorar a viabilidade do seu uso em conjunto com o teste da enzima G6PD realizado no momento do atendimento ao paciente.
A GSK no Brasil e a Medicines for Malaria Venture (MMV) anunciaram que a Agência Nacional de Vigilância Sanitária (Anvisa) concedeu o registro regulatório com priorização de análise da tafenoquina em dose única para a cura radical (prevenção de recidiva) da malária por Plasmodium vivax (P. vivax) em pacientes com 16 anos ou mais que estejam recebendo cloroquina para infecção aguda por P. vivax.
Como dose única, a tafenoquina pode facilitar a adesão do paciente, levando à cura radical e prevenção de recidiva. Assim, torna-se uma alternativa ao tratamento padrão com primaquina que deve ser administrada por sete ou 14 dias. Ao fazer isso, o Brasil se tornou o primeiro país com malária endêmica a aprovar tafenoquina. Antes da medicação ser disponibilizada à população em geral, o Ministério da Saúde, em parceria com a MMV, conduzirá um estudo de viabilidade. Assim, com o objetivo de testar a tafenoquina com o teste da enzima G6PD no cenário de vida real.
Dose única para a cura da malária no Brasil
Este estudo, denominado TRuST, será realizado nos municípios de Manaus e Porto Velho. Sua conclusão está prevista para o primeiro trimestre de 2021 e seus resultados ajudarão o Ministério da Saúde na decisão sobre a melhor forma de disponibilizar a tafenoquina em áreas endêmicas de P. vivax. Até que esta decisão seja tomada, a tafenoquina estará disponível apenas aos participantes do estudo.
De acordo com o pesquisador da Fundação de Medicina Tropical Doutor Heitor Vieira Dourado (FMT-HVD) de Manaus, Dr. Marcus Lacerda, essa aprovação é um passo importante para o controle e eliminação da malária no Brasil e na região amazônica. “Após anos de pesquisa, esperamos ter uma nova opção para a população vulnerável à malária. Assim, permitindo que os pacientes concluam o tratamento.”
Malária no Brasil
“Globalmente, o custo humano e econômico da recidiva da malária é alto”, disse o CEO da MMV, Dr. David Reddy. “Cada episódio de malária mantém uma criança fora da escola ou um adulto fora do trabalho. Em indivíduos suscetíveis, a doença pode até ser fatal. Além disso, à medida que se obtém avanços no combate a outro principal parasita da malária, Plasmodium falciparum, observamos um aumento na proporção de casos de P. vivax. Dessa forma, é tão importante a primeira aprovação de tafenoquina, como uma nova opção, em um país com malária endêmica. Como medicamento de dose única, esperamos que a tafenoquina aumente a adesão do paciente e ajude países a se aproximarem da eliminação da malária.”
Para o presidente da divisão farmacêutica da GSK no Brasil, José Carlos Felner, a aprovação da tafenoquina no País marca outro importante passo na luta pelo combate às doenças negligenciadas. “Somente em 2018, o Ministério da Saúde registrou mais de 194 mil casos da malária. Desse modo, aguardamos agora a conclusão de estudos de viabilidade. Eles ajudarão a determinar os próximos passos sobre a melhor maneira de direcionar o acesso do paciente à tafenoquina no Brasil, como parte dos esforços globais para erradicar a malária.”
*Não se automedique. Consulte um profissional de saúde.
Fonte: Guia da Farmácia
-
 Genéricos ultrapassam 2,3 bilhões de unidades vendidas em 2025
09/02/2026
Categoria amplia presença em 24 das 27 unidades da Federação, com altas expressivas em Pernambuco, Sergipe, Rio de Janeiro e Rondônia.
Genéricos ultrapassam 2,3 bilhões de unidades vendidas em 2025
09/02/2026
Categoria amplia presença em 24 das 27 unidades da Federação, com altas expressivas em Pernambuco, Sergipe, Rio de Janeiro e Rondônia.
-
 Semaglutida pode turbinar lucro das farmácias em até 15%
16/01/2026
O fim da patente do Ozempic, medicamento à base de semaglutida da Novo Nordisk, deve ter efeitos que vão além da indústria farmacêutica. Segundo o Itaú BBA, o lucro das farmácias na bolsa de valores pode crescer até 15% com uma maior oferta de remédios com o princípio ativo. As informações são da CNN Brasil.
Semaglutida pode turbinar lucro das farmácias em até 15%
16/01/2026
O fim da patente do Ozempic, medicamento à base de semaglutida da Novo Nordisk, deve ter efeitos que vão além da indústria farmacêutica. Segundo o Itaú BBA, o lucro das farmácias na bolsa de valores pode crescer até 15% com uma maior oferta de remédios com o princípio ativo. As informações são da CNN Brasil.
-
 50+: sua farmácia está preparada para esse público?
10/11/2025
Segundo a Organização das Nações Unidas (ONU), a população com mais de 50 anos de idade saltou de 15,1% em 2000 para 27,9% em 2024. E a tendência deve se intensificar nas próximas décadas. Para 2050, esse grupo deve chegar a 42,3% dos brasileiros e, para 2078, estima-se que ele ultrapasse os 50%, impulsionando mudanças profundas na economia, na saúde e nos padrões de consumo.
50+: sua farmácia está preparada para esse público?
10/11/2025
Segundo a Organização das Nações Unidas (ONU), a população com mais de 50 anos de idade saltou de 15,1% em 2000 para 27,9% em 2024. E a tendência deve se intensificar nas próximas décadas. Para 2050, esse grupo deve chegar a 42,3% dos brasileiros e, para 2078, estima-se que ele ultrapasse os 50%, impulsionando mudanças profundas na economia, na saúde e nos padrões de consumo.